2. ケミカルバイオロジー Chemical biology
精製された基質の変換反応を目的とする合成化学研究では、反応条件 (触媒、試薬、溶媒、反応温度等) をチューニングすることで、収率や選択性を指標に最適化を行います。しかし、細胞由来の混合物を研究対象とした場合、これらにダメージを与えることなく、狙った反応点を選択的に修飾することは未だに困難です。一方、生体では、様々な官能基が内在する生体高分子が無数に存在する環境においても、酵素が標的基質を認識することで様々な結合・切断反応が選択的に実現されています。本研究では、タンパク質メチル化反応をモデル題材として、化学の言葉で複雑な生命反応を単純化し、そして制御することを目指しています。
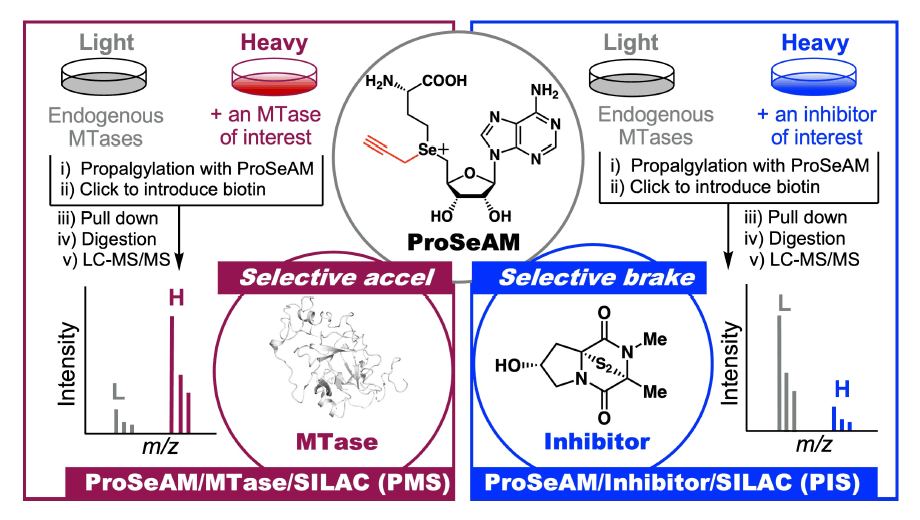
2-1) 検出系の開発: 見る。(PMS: ProSeAM/MTase/SILAC)
タンパク質メチル化反応は、生命機能の制御に不可欠な翻訳後修飾反応です。しかし、生体で起こるメチル化反応のほんの一部しか解明されていません。
私たちは生物学者とは異なるアプローチでメチル化反応を検出する技術を開発しました。すなわち、天然のメチル源SAM (S-adenosylmethionine) の誘導体を用い、基質タンパク質に人工的目印を導入する戦略を確立しました。特に、「ProSeAM (propargylic Se-adenosyl-L-selenomethionine)」を用いた場合、最も効率的にプロパルギル基 (人工的目印)を基質タンパク質に導入できることを見いだしました。また、酵素は自然界の触媒であることに着眼し、酵素を添加した場合、ProSeAM によるプロパルギル化反応が増幅できることを明らかとしました。この原理と比較定量法 SILAC (stable isotope labeling by amino acids in cell culture) とを組み合わせたPMS 法 (ProSeAM/MTase/SILAC) を確立しました。これにより同一クロマトグラム中で、酵素と基質を精度高く相関付けることが可能となりました。本方法は汎用性が高く、数種の新規非ヒストン基質とその修飾サイトを同定することに成功しています。
2-2) 阻害剤の開発: 制御する。(PIS: ProSeAM/Inhibitor/SILAC)
従来のタンパク質メチル化阻害剤の開発研究では、「1酵素–1基質–1サイト」のメチル化反応を指標に、阻害剤の構造最適化が進められます。一方、私たちは、 ProSeAM を用いる検出系を応用して、タンパク質メチル化阻害剤が「どのタンパク質のメチル化を、どの程度阻害するのか」をプロテオームレベルで評価する ProSeAM/Inhibitor/SILAC (PIS) 法を開発しました。天然物chaetocinをシード化合物として設定し、その構造と活性との相関を明らかにする過程において、毒性が軽減された新規アルギニンメチル化阻害剤を創出することに成功しました。
Reviews: Acc. Chem. Res. 2021, 54, 3818–3827; Chem. Rec. 2018, 18, 1660–1671.
Representative papers: PLOS ONE, 2014, 9, e105394; Chem. Commun. 2018, 54, 9202–9205; Nat. Commun. 2021, 12, 891; Genes. Dev. 2023, 37, 724–742.
Chem-Station スポットライトリサーチ: 化学の力で複雑なタンパク質メチル化反応を制御する